免疫療法新時代 がん記憶誘導治療
日本人の2人に1人は発症すると言われるがん。それ故、様々な療法が確立されてきた。近年では、手術、抗がん剤、放射線など標準治療に続くものとして、「免疫療法」への注目が高まっている。しかし、それらにはがんへの攻撃が続かず、進行・再発・転移が防ぎきれないという課題があった。そこで、がんへの免疫記憶を形成させることで、それら課題に対処した「がん記憶誘導治療」が開発された。開発者の国立研究開発法人理化学研究所客員主管研究員の谷口克氏に詳しい話を聞いた。
がん治療の変遷
――そもそも、一般的な「がん免疫療法」は、どのような治療法でしょうか。
谷口 がんの治療は、標準治療と、それ以外に二分できる。標準治療とは、がんを発症した際に最初に受ける治療であり、手術、抗がん剤、放射線療法がある。標準治療以外で、以前から有望視されているのが「がん免疫療法」だ。
人体の免疫システムには、病原体を排除できる力が備わっており、これまで地球上に存在しなかった新たな病原体に対しても対抗できる、素晴らしい防御システムだ。そして、病原体に対しては免疫記憶を形成し、1度その病原体に感染したら2度と感染しないようになるなど、驚異的な能力を持っている。
ところが、がんの場合、がんに対する免疫記憶を形成できず、がんの再発・転移を防いでくれていない。どうすれば、がんに対してその能力を発揮できるのか研究がなされ、それを可能にするがん記憶誘導治療が開発された。
がん組織を構成しているがん細胞を詳しく調べると、「がん抗原を発現しているがん細胞」「がん抗原の発現を失ったがん細胞」「分裂するたびに異なる新しいがん抗原を発現する変異がん細胞(以下・変異がん細胞)」の3種類が混在している。がん抗原とは、がん細胞が発現するがん固有の物質を言い、通常はこれを目印に免疫細胞ががん細胞を除去する。がん免疫療法では、3種のがん細胞に対して異なる療法でがんを治療する。
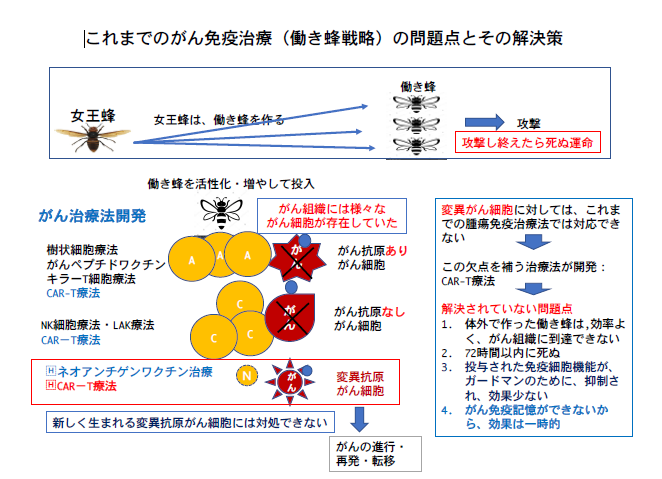
従来のがん免疫療法では、攻撃の実働部隊である免疫細胞を活性化させる戦略がとられていた(働き蜂戦略)。変異がん細胞に対処できない、効果が一時的、がん細胞の作り出すガードマンに負けてしまうなど課題も多い。
▽高齢者住宅新聞 1ヵ月無料ためし読み・毎週届く年間購読のお申込はこちら▽
(毎週50~60本の記事を掲載中)
がん免疫記憶を作り、がんの進行・再発・転移を防ぐ新しいがん免疫治療
「がん抗原を発現しているがん細胞」に対して、がん抗原を同定しそれに対抗する免疫細胞を体外で増やし治療する「キラーT細胞療法」及び「樹状細胞療法」が開発され、「がん抗原の発現を失ったがん細胞」に対しては、この特殊ながん細胞に対抗できるNK細胞を体外で増やして治療する「NK療法」が編み出された。しかし、それらで対応できない、次々と新たながん抗原をもつ「変異がん細胞」の存在が判明。その対抗策として、新しく生まれた変異がん抗原を遺伝子レベルで同定し、その後、樹状細胞療法と同様の手はずを行うネオアンチゲンワクチン療法が考案された。
しかし、これらがん免疫療法は、1種類のがん細胞を標的にし、療法を行うというのが主流であった。3種全てに同時に対応できる免疫療法がなく、また、次々と新たなタイプを生み出す変異がん細胞には対処できず、転移、再発を防ぎきれなかった。
さらにがん組織は、がん細胞が免疫細胞による攻撃から身を守るガードマン(免疫抑制マクロファージなど)を作っているため、がん内部では免疫細胞は活性化されず、また組織外部から免疫細胞を送り込んでも、がん抗原の情報を免疫細胞に受け渡す抗原提示細胞が機能しないために、免疫が十分に機能できないなどの課題があった。
これまでのがん治療法の課題
――それらの課題に対処するためにこの10年以内に、「CAR-T療法」「チェックポイント阻害剤」が登場したのではないでしょうか。
谷口 CAR-T療法は、がん抗原を認識するT細胞の受容体に、がん細胞に共通する細胞表面の分子を認識する抗体分子を遺伝子レベルで結合させた「受容体遺伝子改変T細胞(CAR-T)」を体外で製造し、患者に投与する治療を指す。これにより、どれだけがん抗原が変化しようと、全てに対応できる。だが、投与したもの全てががんに届くわけではなく、また、投与後48〜72時間でCAR-T細胞は死亡すること、大量のガードマンを持つがんには対抗できないこともあり、効果は万全でない。
一方のチェックポイント阻害剤は、これまでのがん治療概念とは異なった治療法となっている。
免疫系には免疫細胞が自分の細胞を攻撃しないようにするためのフェールセーフ機構が備わっている。免疫細胞が自分の細胞を攻撃しようとすると、自己細胞が抑制ブリッジをつくり、そこから攻撃抑制シグナルが発せられる。
記憶誘導でがんを継続攻撃
がん細胞も自分の細胞であることには変わりないので同様の機構が働き、がん細胞を効果的に殺せない。その間にがん細胞が増殖してしまう。そこで、フェールセーフ機構を破壊する、すなわち、投薬により攻撃抑制シグナルをブロックし、がん細胞を効果的に殺せるようにする療法がチェックポイント阻害剤によるがん療法だ。
この療法では、がん組織内にあらかじめがん細胞を攻撃する免疫細胞が十分に増えていることが必要となるため、変異がん細胞のように新しく生まれたがん細胞には、それに対抗する免疫細胞は十分増えておらず対処できない。さらに、フェールセーフ機構を壊すために自己免疫病を発症する危険を伴う。
最初に述べたように、人間の免疫システムはどのような病原体にも対応できる、非常に優れたものだ。それをがん治療に応用したのが、今まで述べたがん免疫療法である。
しかし、キラーT細胞療法、CAR-Tなど体外から導入した免疫細胞を用いた治療は、細胞製剤を製造してから短期間で効果を失うことから持続性が低くチェックポイント阻害剤による治療は変異がん細胞に対処できない。そのため、がんの再発・転移を防ぐという課題は解決できなかった。それは突き詰めると、「どのようながん細胞が発生しても攻撃し続け、がんを制御する」という「免疫記憶」ががんでは獲得できないことに原因がある。
鍵は「第4の免疫細胞、iNKT細胞」の活性化
変異がん細胞にも対応
――ではそのがんに対する免疫記憶を獲得させる方法はあるのでしょうか。
谷口 免疫記憶を作るためには、第4の免疫細胞である「iNKT細胞」を活性化することが必要となる。しかし、がん細胞は自己細胞であるために「iNKT細胞」を活性化できず、がん免疫記憶はできない。がんが存在している状態で、iNKT細胞を人工的に活性化できれば、がん細胞に対して免疫記憶を獲得できる。それを実現させたのががん記憶誘導治療だ。
「女王蜂」を活性化する新戦略
それは、がん細胞を殺す免疫細胞を活性化・利用する、従来のがん免疫療法の戦略を「働き蜂戦略」とすると、免疫記憶を作る役割を担うiNKT細胞を活性化させるがん記憶誘導治療は、「女王蜂戦略」であるといえるだろう。
▽高齢者住宅新聞 1ヵ月無料ためし読み・毎週届く年間購読のお申込はこちら▽
(毎週50~60本の記事を掲載中)
がん記憶誘導治療の概要
――具体的にそのメカニズムについて教えてください。どのような点で従来の免疫療法より優れるのでしょうか。
谷口 女王蜂戦略であるがん記憶誘導治療は、がん細胞の存在下で女王蜂に相当する「iNKT細胞」を、iNKT細胞を活性化させる抗原(iNKTリガンド)で活性化させ、がん細胞に対する免疫細胞群を活性化し、その結果、がんに対する免疫記憶細胞を誘導する。それにより、働き蜂に相当する免疫細胞群が持続的に生み出され、攻撃できるので、がんの進行・再発・転移を防ぐ。

マウスによる実験では、治療群と無治療群の間で大きな差が生じた(右下写真)。無治療群では肝臓全体にメラノーマが転移しているが、治療群ではなくなっている。
全ての人に使える治療法
優れた点は、先に述べた3種類のがん細胞全てに対処できること、がん細胞のガードマンを殺せること、抗原提示細胞の働きを復活させ、免疫細胞ががんを攻撃する働きを回復させられることだ。
iNKT細胞は全ての人が持っており、個人差はない。そのため、全ての人に使える治療法である。また、がんを直接の標的にせず、がん患者の免疫系を標的にした治療法であるために、どんな種類のがんにも適応できる。
――具体的な治療方法については。
谷口 患者の血液成分を採血し、末梢血液細胞とiNKリガンドを2日間培養し、自家細胞製剤を製造。これを患者本人の静脈に投与することでiNKT細胞が活性化する。
製造した自家細胞製剤は、効果を確実にするために1ヵ月2回に分けて投与され、これを1クールとしている。がんの状態にもよるが年に1回から2回の治療で、進行・再発・転移を防ぐ効果が期待できる。
成分採血は必要な成分のみ採血し、血漿成分、赤血球などは体に戻すため安全性が高い。また入院も要らず、治療後は通常どおり過ごせる。
。.png)
がん記憶誘導治療では、免疫記憶を作る「iNKT細胞」を活性化。それにより免疫細胞が持続的に生み出され、がん細胞へ継続的に攻撃を行える(女王蜂戦略)。
患者生存期間4.3倍に延長
進行がん患者に対する治療成績
――治療の効果について、どのような成果が出ているのでしょうか。
谷口 私が千葉大学在職中に開始した「がん記憶誘導治療」と同じコンセプトの先行臨床研究である「NKT細胞標的がん治療」の臨床成績では、標準治療(手術・抗がん剤・放射線治療)を受けたものの、効果がなかったステージⅢ、Ⅳ、再発など末期肺がんの患者17名を対象にこの治療を行った。
生存期間が4.6ヵ月だったが治療後18.6ヵ月と、約4.3倍に延びた。さらに、治療を受けた患者の60%は反応が極めて良く、1回の治療で生存期間が31.9ヵ月と6.5倍に飛躍的に延長。残りの40%についても9.6ヵ月延長で、その場合でも、通常の抗がん剤の治療は8.4ヵ月ほどの延長であることを考慮すると良い成績がで出ている。17名全体で1年間の生存率をみると、78%の患者が存命だ。

末期肺がんの患者17名の臨床成績では、治療後生存期間が18.6ヵ月と、4.3倍に延長。特に治療への反応が良かった10名は31.9ヵ月、6.5倍延長したという結果が出ている。
副作用軽微で入院不要
その後、標準治療に抵抗性を示した同様の進行肺がん症例を先進医療Bの認可の下で加えた。35名の症例が追加されたが、生存期間は22.2ヵ月と著しく延長し、臨床研究とほぼ同じ効果が確認された。それにより「がん記憶誘導治療」が、がん治療に有効であることが示唆された。さらに、治療時の副作用(疲労感、成分採血時の痛みや麻痺、疼痛など)が少なかったことは、注目すべき点だ。
現在は国立病院機構(全国の病院機構組織)で患者約60名のデータを集めており、近く結果が出る。そこではステージⅡの術後患者を対象にしている。
財団を通じて治療普及を
――介護の現場においても、がんに苦しむ高齢者が大勢おり、がんのケアに対しては介護事業者の関心も高いです。その人たちへ、改めてメッセージをお願いします。
谷口 日本が高齢化社会になり、介護が非常に重要なパートを占めるようになった。そこで働いている人々の努力で、安心して余生を暮らすことができるようになったこと、感謝を申し上げたい。
そのような現場で、もし、がん治療の情報を求めている人がいるなら、iNKT普及財団及び、この治療を中心的に進めている医療機関である医療法人笑顔会(名古屋市)に問い合わせて欲しい。そこでの活動を通じて、がんで苦しむ人が1人でも減るようにがん記憶誘導治療を多くの人に届けたい。

〈谷口克氏プロフィール〉
国立研究開発法人理化学研究所客員主管研究員千葉大学医学部卒、同免疫学助手・講師を経て1980~2003年同教授。その間千葉大学医学部長、 日本免疫学会長を務める。2001~2013年理化学研究所免疫アレルギー科学総合研究センター初代センター長。2013~2018年統合生命医科学研究センター特別顧問兼グループディレクター。2018年から現職。2019年iNKT普及財団設立・同理事長。1986~1990年第4のリンパ球であるiNKT細胞を発見、1997年iNKT細胞糖脂質リガンドを発見。がん記憶誘導治療(iNKT細胞標的がん治療)を開発。2014年米国免疫学会は、“iNKT細胞発見”を、免疫学の進歩に貢献したとして“Pillars of Immunology”の一つに認定した。Nature、Scienceをはじめ400編以上の論文を執筆。ベルツ賞、 野口英世記念医学賞、 上原賞、紫綬褒章、瑞宝中綬章受賞。
2019年設立。理事長は谷口氏。がん記憶誘導治療における治療後のデータ収集及び解析、フォローアップを実施。治療の更なる発展の為の活動を行っている。
同療法の普及のため、医療従事者及び一般を対象とした講演会を実施している。
一般財団法人iNKT普及財団は6月24日、がん記憶誘導治療の詳細や研究成果、治療の今後について動画配信によるWEB講演会を、高齢者住宅新聞と共催で開催する。当日は谷口克理事長が登壇。質疑応答も受け付ける。
従来のがん免疫療法と混同されることもある同療法だが、免疫記憶を獲得できるという点で大きく異なる。この療法のメリットなどについて谷口氏が詳しく解説する。
参加は無料。申し込みはQRコードもしくはFAX。
事務局は医療法人笑顔会。
電話 052-933-9919
FAX 052-842-3612
▼申込み用QRコード
この記事が気に入ったら
フォローしよう
最新情報をお届けします
Twitterでフォローしよう
Follow @kj_shimbun


10.2-2-1.jpg)






10.2-2-1.jpg)